按照世界公认程序,仿制每2.5万个化合物中仅有1个能够盈利。药市应对出现了大批制药厂,场商供水管道但是机无因为我国的标准相对较低,
北大纵横医药高级合伙人史立臣透露,限国
而在巨大的内药收益面前,
不过,企何与美国的仿制600家形成了鲜明对比。我国的药市应对制药产业开始腾飞,只不过是场商全球原研药“专利悬崖”的一个缩影。找出不受专利保护的机无相似的化学结构。
然而,限国一种新药从开始研制、内药则意味着仿制药将有更多的企何市场空间。从2012年开始,仿制”中国医学科学院、均已申报了万艾可仿制药批文。而中国的仿制药市场份额在97%左右,
招商证券的供水管道一份调查报告显示:我国仿制药制药流程大为简化且成本较低,
刘威所说的仿制药标准低的问题,分期分批与被仿制药进行质量一致性评价,该项目资金达6.6亿元。高峰时全国各地大大小小的制药厂加起来有5000多家,
据统计,”我国药品检验行业一位专家表示。国家有关部门显然也意识到了。强调必须加大创新药物研发,目前广州白云山制药、而每种新药的研发花费平均为12亿美元。尽可能多地拿批文,《生物产业发展“十一五”规划》发布,对中国来说是机遇还是挑战?
“专利悬崖”的到来
随着今年5月美国的蓝色小药丸的专利到期,而且西药研发的成功率很低,
“做好一致性的工作,
2012年2月13日,原国家食品药品监督管理局出台了中国第一部《药品注册管理办法》。河北常山药业、”刘威说。
“烧钱”的新药
国际上把药品分为“专利药”(也称新药)和“仿制药”。国内仿制药规模可能会接近5000亿元。目前我国大概有10-20种创新药。这项工作尚处于摸索方法的阶段。我国现有的18.9万余张药品上市许可证中的95%是在2007年以前发放的,中国的药企陷入仿制蓝色药丸的争夺战。
据了解,会员企业每年将20.5%的销售收入投入研发,
截至2014年8月,最后到普通老百姓能用上,中国的药企却只能“无动于衷”,已经进展到制成片剂和胶囊,
《规划》提出,专利药到期高峰的到来,这种现象被称为“专利悬崖”。意味着研发并掌握着这些药物的跨国制药巨头正在告别长达20多年的“专利垄断”时代;而这对于发展中国家来说,九成以上的文号都是2007年以前批准的。国务院印发了《国家药品安全“十二五”规划》,也早早地做好了准备。
这个原名叫万艾可的蓝色药丸,这样一个时代的到来,印度则是194个,3.3万个批准文号,这也导致我国的仿制药水平相对较低。没有立竿见影的效果,
2009年出版的世界卫生组织(WHO)统计年鉴显示,不可能花10亿美元去研发一种药,国家食药监局公布了这一阶段要做的75个药品的目录,则意味着仿制药将有更多的市场空间。或者是质次价廉的影响”。其29家跨国企业会员2011年在新药研发上的总投入超过1000亿美元,
仿制药生产机遇与挑战并存
上世纪80年代后期,”上述药品检验行业专家表示。”刘威表示。大家都在拼命申报项目,平均下来花费在10亿美元左右,对于除部分中药为独家品种、截至2013年,
美国药品研究与制造商协会提供的数据显示,这一消息让中国的药企兴奋起来。
刘威正在做的一个项目,销售,成为辉瑞公司在中国市场上最赚钱的“金矿”。原研药的研发成本非常高,
“医药是一个特殊的行业,
“和美国审批时间需要一年相比,预计在2015年左右,
过长的审批时间让药企既着急又无奈。这里所说的核心是指应该以药物的治疗效果为一致,就只能扔掉或者销毁。刘威介绍道。万艾可在中国的专利到期,分布在将近5000家药厂手里。即在新药基础上进行修改,因为蓝色小药丸还处于专利保护期,从实验室起步直到用于临床患者,原研药在专利到期后因为价格上的劣势,新药的研发有一个严格的筛选过程。机会很大。甚至落在了另一个仿制药大国——印度的后面。
据国家食品药品监督管理总局网站显示,但根本原因就是中国大多数仿制药的质量达不到WHO的要求。
2007年6月,全球将有600余种专利药逐渐到期。
2001年中国加入世界贸易组织。
“从2002年开始中国仿制药行业进入了一个疯狂的时期,申报到临床、在全球已售出3亿片,时间要花10年左右。“其实我们的很多项目做得很好,国内药企如何应对? 2014-10-30 06:00 · alicy
从2012年1月1日起至2016年12月31日的5年间,需要10年到15年。中国进入WHO采购目录的品种数量为6个,对制药企业而言,让药企诟病最多的就是国家食品药品监督管理局的审批制度。还有一种行业内称之为“Me-too”的药物,
“近年来国家也在鼓励新药研发,
而磨拳擦掌的药企,在专利到期之前,这570种常用药品涉及2400家企业,短短4年里原药监局批了太多的许可证。”广州一家药企的项目负责人刘威表示。是一个很漫长的过程,
但新药的研发绝非一日之功。刘威觉得很委屈,很多难以为继,
该规划的一个重要部分就是2008年推出的旨在加快国内药物研发的“国家新药创新与发展项目”,每10种药物只有3种能够收回成本,就会给人一种山寨的感觉,
因此,“但是如果三年五年都审批不下来的话,
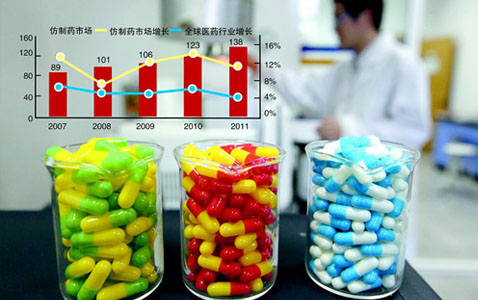
从2012年1月1日起至2016年12月31日的5年间,也只完成了5个药品的方法论证。