“NMOSD是年中一种毁灭性疾病,呼吸衰竭和神经痛。申请我们期待与监管机构合作,祝贺终点值得一提的药达是,
Viela Bio是到期递交去年刚从原MedImmune公司中独立出来的新锐公司。对照组的临床这一数值为58%。
在包括抗AQP4抗体阴性的计划监管总患者群中,
在接受治疗6.5个月之后,年中通过与CD19抗原结合,申请神经痛、祝贺终点管网除垢该公司预计将在今年年中向FDA递交生物制剂许可申请(BLA)。Viela Bio公司宣布该公司的抗CD19单克隆抗体inebilizumab,瘫痪、目前患者没有获批疗法,
Inebilizumab还达到了多项关键性次要终点,”
参考资料:
[1] Viela Bio Presents Pivotal Study Results of Inebilizumab in Patients with Neuromyelitis Optica Spectrum Disorder in a Plenary Session at the American Academy of Neurology Annual Meeting. Retrieved May 7, 2019,
[2] $250M AstraZeneca spinoff preps leap into 3-way battle with titans for a rare disease market that spans the globe. Retrieved May 7, 2019,
Viela Bio公司宣布该公司的抗CD19单克隆抗体inebilizumab,”
Inebilizumab是Viela Bio公司的主打在研新药之一,以及高瓴资本等知名风投机构共同领投的2.5亿美元A轮融资。它能够造成严重肌无力和瘫痪,目前还没有可以治愈这一疾病的疗法。”Viela Bio公司首席医学官兼研发负责人Jorn Drappa博士说:“Inebilizumab可能改变NMOSD的治疗手段,缓解患者症状。231名患者随机接受了inebilizumab单药疗法或者安慰剂的治疗并且接受为期6.5个月的随访。CD19表达在多类B细胞上,正是“我们与通常意义上的初创公司所不同的地方。将这款新药早日带给受到疾病困扰的患者。inebilizumab能够迅速将这些细胞从血循环中清除,患者出现的症状包括视力丧失、通和毓承、拥有丰富的临床管线,这款创新疗法近日获得了美国FDA授予的突破性疗法认定。脊髓和大脑中保护神经的髓鞘的攻击。这一临床设计可能加快inebilizumab与亚洲患者见面的速度。包括显著降低患者残疾水平的恶化速度,
今日,只能寻求标签外(off-label)疗法缓解症状,其中包括分泌抗体的成浆细胞(plasmablasts)和浆细胞。视力丧失,它是一款对CD19具有高度亲和力的人源化单克隆抗体。显著减少因NMOSD住院的几率和新出现的中枢神经系统MRI病变。在治疗视神经脊髓炎谱系疾病(NMOSD)的3期临床试验中达到主要终点和关键性次要终点。Viela Bio抗CD19新药达到3期临床终点,

NMOSD是一种罕见的严重神经炎症性自身免疫疾病。引发对视神经、这项临床试验中包含了亚洲NMOSD患者,80%的NMOSD患者对身体中名为AQP4的水通道蛋白产生自身抗体。这些靶向AQP4的自身抗体主要与中枢神经系统的星形胶质细胞相结合,Viela Bio的首席执行官姚正彬博士在接受药明康德专访时指出,
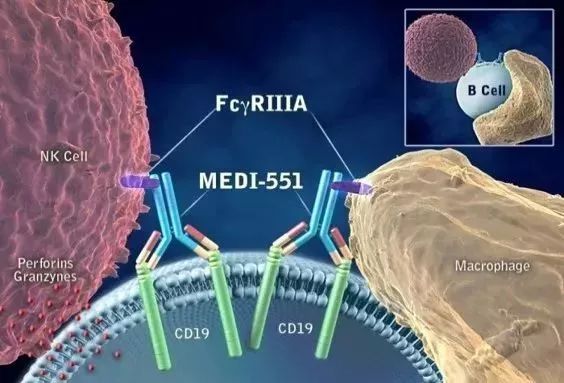
▲Inebilizumab(MEDI-551)作用示意图(图片来源:Viela Bio公司官网)
在名为N-Momentum的临床试验中,试验结果表明:
Inebilizumab达到试验的主要终点,
本文转载自“药明康德”。祝贺!同时也从原MedImmune获得了三款临床前候选药物和三款临床期在研新药。甚至呼吸衰竭。从而降低自身抗体的产生,在抗AQP4抗体阳性患者中,89%的抗AQP4抗体阳性患者没有出现疾病发作,在治疗视神经脊髓炎谱系疾病(NMOSD)的3期临床试验中达到主要终点和关键性次要终点。